脑脊液、关节腔、玻璃体等人体封闭解剖腔隙中,神经毒性代谢物的病理性蓄积正成为威胁健康的“隐形杀手”。这类毒素不仅会引发严重且不可逆的组织损伤,尤其对再生能力有限的中枢神经系统危害巨大 —— 例如胆红素诱发的神经毒性可导致急性胆红素脑病,通过破坏线粒体功能、损伤突触及引发神经炎症等多种机制,造成永久性神经元损伤。然而,当前临床治疗手段仍依赖侵入性操作,疗效有限,且体外循环吸附疗法难以精准靶向清除封闭腔隙深处的毒素,给患者带来诸多治疗困境。

近日,我院梅永丰/黄高山/陈相仲团队联合复旦智慧医疗超声实验室许凯亮团队、东华大学生物医学工程学院刘宣勇/赵哲团队共同提出了一种名为“Ultrasound Microbubble@PCN-333(Fe)(UMPCs)” 的多功能磁控微机器人,其独特设计实现了靶向导航、高效解毒与超声监测的三位一体,为体内精准医疗提供了新范式。相关成果发表在《Advanced Materials》,题目为《MOF-Functionalized Ultrasound-Trackable Magnetic Microrobots for Intracranial Toxin Removal》。
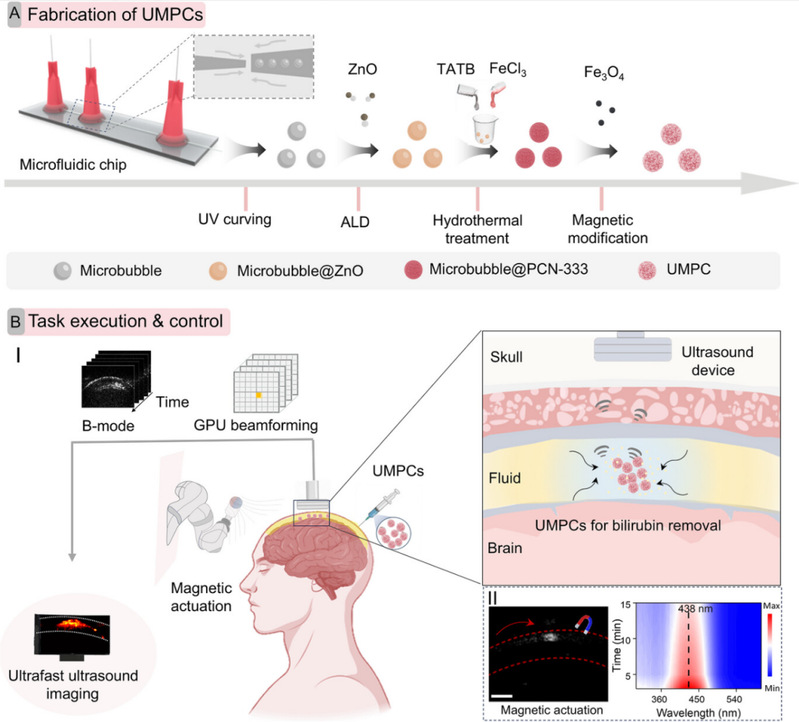
图1. 微机器人的设计制备和靶向执行医学任务的场景
微机器人由三层核心功能结构组成:内部为含有气芯结构的水凝胶微泡,可显著增强超声成像对比度,为实时超声追踪提供支撑;外层利用原子层沉积技术诱导生长有机金属框架(PCN-333)层,凭借多孔骨架结构提供的丰富位点和配体与胆红素分子之间相互作用,具备极强的胆红素吸附能力,可实现主动高效的胆红素捕获;表层修饰磁性氧化铁纳米颗粒,赋予微机器人磁响应运动能力,可在外部磁场引导下精准穿梭于复杂生理环境。微机器人系统整合了超声实时追踪功能,能够精准定位微机器人在体内的运动位置,实现“导航 - 吸附 - 监测” 多功能集成及闭环治疗。团队通过体外胆红素吸附实验与兔颅内活体实验,充分验证了该技术的有效性。此外,该微机器人的设计理念还可延伸至关节腔、膀胱等封闭生理环境的其他毒素清除,为多种毒性代谢物相关疾病的治疗提供了通用型解决方案。未来,该技术有望为急性胆红素脑病等疾病患者带来更安全、更有效的治疗选择,推动以微型机器人为平台的靶向解毒疗法进入精准化、微创化的新时代。
论文第一作者为复旦大学智慧纳米机器人与纳米系统国际研究院博士生梅宇和复旦大学智慧医疗超声实验室博士生程双毅;通讯作者为东华大学生物医学工程学院赵哲副研究员,复旦大学智慧医疗超声实验室许凯亮研究员,复旦大学智慧纳米机器人与纳米系统国际研究院陈相仲青年研究员、梅永丰教授、黄高山教授。论文研究工作得到了复旦大学附属华山医院运动医学科和中国科学院上海硅酸盐研究所的大力支持。该工作获得国家重点研发计划、国家自然科学基金、上海市科委等项目的资助。
文章信息:Yu Mei#, Shuangyi Cheng#, Shunyao Li, Zhe Zhao*, Yuan Chen, Jinlong Wang, Guohonghao Zeng, Jiayuan Huang, Ji Tan, Ziyu Zhang, Guoao Ma, Xuanyong Liu, Jun Chen, Kailiang Xu*, Xiangzhong Chen*, Yongfeng Mei*, Gaoshan Huang*, MOF-Functionalized Ultrasound-Trackable Magnetic Microrobots for Intracranial Toxin Removal, Adv. Mater. 2025: e16357.
文章链接:https://doi.org/10.1002/adma.202516357
MOF-Functionalized Ultrasound-Trackable Magnetic Microrobots for Intracranial Toxin Removal
Toxin accumulation within specialized microenvironments, such as cerebrospinal fluid (CSF), poses significant clinical challenges. In particular, bilirubin in CSF can cause severe damage to the brain and neural tissues. Current therapeutic strategies for intracranial bilirubin clearance suffer from poor targeting, inadequate detoxification capacity, and reliance on invasive procedures. Here, we demonstrate multifunctional microrobots designed for toxin removal in specialized anatomical compartments. The proposed ultrasound-trackable microbubbles@PCN-333 microrobots (UMPCs) feature a hollow hydrogel microbubble core for enhanced ultrasound imaging contrast, an outer metal–organic framework (MOF) layer for proactive and high-capacity toxin adsorption, and embedded ferroferric oxide (Fe3O4) nanoparticles to enablec. Magnetic actuation enhances the UMPC's bilirubin capture efficiency through improved mass transfer. By integrating an ultrafast ultrasound imaging system with magnetic actuation, we achieve real-time tracking and precise control of UMPCs within the CSF. This strategy offers a minimally invasive and actively guided approach for efficient intracranial bilirubin clearance, opening new avenues for targeted toxin-removal in anatomically confined environments.
